Axit là gì? Tính chất hóa lý, ứng dụng trong đời sống

Axit là gì?
Axit là một hợp chất hóa học trong đó phân tử chứa một hoặc nhiều nguyên tử hiđro liên kết với gốc axit (chẳng hạn như -Cl, =SO₄, -NO₃). Những nguyên tử hiđro này có thể được thay thế bằng nguyên tử kim loại, tạo thành muối.
.png)
Đọc thêm: Axit HCl là gì? Tính chất hoá lý, điều chế, ứng dụng và lưu ý khi sử dụng
Tính chất hóa lý của axit
Tính chất hóa học của axit
Làm đổi màu chất chỉ thị: Axit có khả năng làm đổi màu một số chất chỉ thị như quỳ tím, giấy chỉ thị pH và dung dịch phenolphtalein.
Phản ứng với kim loại: Một số axit có thể tác dụng với kim loại để tạo thành muối và giải phóng khí hydro. Đối với axit sulfuric (H₂SO₄) và axit nitric (HNO₃) đặc, nóng, chúng có thể phản ứng với hầu hết các kim loại, tạo ra lưu huỳnh dioxit (SO₂) hoặc nitơ dioxit (NO₂):
HCl + Fe → FeCl₂ + H₂
2Fe + 6H₂SO₄ → Fe₂(SO₄)₃ + 6H₂O + 3SO₂
Phản ứng với bazơ: Axit kết hợp với bazơ tạo ra muối và nước theo phương trình:
Cu(OH)₂ + H₂SO₄ → CuSO₄ + 2H₂O
Phản ứng với oxit bazơ: Axit có thể tác dụng với oxit bazơ để tạo ra muối và nước:
Na₂O + 2HCl → 2NaCl + H₂O
FeO + H₂SO₄ (loãng) → FeSO₄ + H₂O
CuO + 2HCl → CuCl₂ + H₂O
Phản ứng với muối: Axit cũng có thể tác dụng với một số muối, tạo ra muối mới và axit mới.
.png)
Tính chất vật lý của axit
Hầu hết các axit đều dễ tan trong nước, tạo thành dung dịch có vị chua đặc trưng. Đây cũng là lý do các loại trái cây chứa axit tự nhiên, như cam, chanh hay dứa, thường có vị chua.
Khi chạm vào axit mạnh, đặc biệt là axit đậm đặc, có thể gây cảm giác đau nhói hoặc bỏng rát do axit ăn mòn da và niêm mạc. Vì vậy, khi làm việc với axit, cần sử dụng các biện pháp bảo hộ như găng tay và kính bảo vệ.
Axit thuộc nhóm chất điện li, tức là khi hòa tan trong nước, chúng phân ly thành ion, giúp dung dịch có khả năng dẫn điện. Điều này được ứng dụng trong nhiều lĩnh vực, đặc biệt là trong công nghệ pin và điện phân.
.png)
Đọc thêm: Data Center Cooling là gì? Giải pháp làm mát máy chủ hiệu quả cho doanh nghiệp
Phân loại axit
Dựa trên tính chất hóa học của axit
Axit mạnh: Bao gồm axit sulfuric (H₂SO₄), axit clohydric (HCl), axit nitric (HNO₃),... Những axit này khi hòa tan trong nước phân ly hoàn toàn, tạo ra dung dịch có tính axit rất cao với độ pH nhỏ hơn 7 đáng kể. Chúng có khả năng ăn mòn mạnh và thường được sử dụng trong công nghiệp hóa chất, luyện kim và sản xuất phân bón.
Axit yếu: Chẳng hạn như axit cacbonic (H₂CO₃) và hydro sulfua (H₂S). Khi hòa tan trong nước, chúng chỉ phân ly một phần, tạo ra dung dịch có độ pH gần 7. Do tính axit yếu, chúng ít gây ăn mòn hơn và thường xuất hiện trong tự nhiên, như trong nước có ga hoặc khí thải từ quá trình phân hủy hữu cơ.
Dựa trên thành phần oxy
Axit không chứa oxy: Đây là nhóm axit mà phân tử chỉ bao gồm nguyên tử hiđro liên kết trực tiếp với một nguyên tố khác, mà không có sự xuất hiện của oxy. Một số ví dụ tiêu biểu gồm axit clohydric (HCl), axit hiđroiodic (HI), axit hiđrosunfua (H₂S), axit hiđrobromic (HBr) và axit flohiđric (HF).
Axit chứa oxy: Nhóm axit này có trong thành phần phân tử nguyên tử oxy, thường liên kết với nguyên tố trung tâm. Một số axit điển hình thuộc nhóm này là axit sulfuric (H₂SO₄), axit photphoric (H₃PO₄), axit cacbonic (H₂CO₃) và axit nitric (HNO₃). Chúng đóng vai trò quan trọng trong nhiều lĩnh vực như công nghiệp, nông nghiệp và sinh học.
Phân loại axit theo nguồn gốc
Axit vô cơ: Là những axit có nguồn gốc từ khoáng chất và không chứa liên kết cacbon-hydro đặc trưng của hợp chất hữu cơ. Một số axit vô cơ phổ biến bao gồm axit clohydric (HCl), axit nitric (HNO₃) và axit sulfuric (H₂SO₄). Chúng thường có tính ăn mòn cao và được ứng dụng rộng rãi trong công nghiệp, thí nghiệm hóa học và sản xuất phân bón.
Axit hữu cơ: Là nhóm axit có chứa nhóm -COOH (cacboxyl) trong cấu trúc phân tử, thường xuất hiện trong sinh vật sống. Một số đại diện tiêu biểu gồm axit fomic (HCOOH) và axit axetic (CH₃COOH), vốn có mặt trong giấm ăn và nhiều quá trình sinh học. So với axit vô cơ, axit hữu cơ thường có tính axit yếu hơn và ít ăn mòn hơn.

Ứng dụng quan trọng của axit trong đời sống
Axit đóng vai trò thiết yếu trong nhiều lĩnh vực, từ công nghiệp, y học đến thực phẩm và sinh học. Dưới đây là một số ứng dụng nổi bật của axit:
Ứng dụng trong công nghiệp
Axit thường được sử dụng để làm sạch bề mặt kim loại, loại bỏ gỉ sét và hạn chế quá trình ăn mòn.
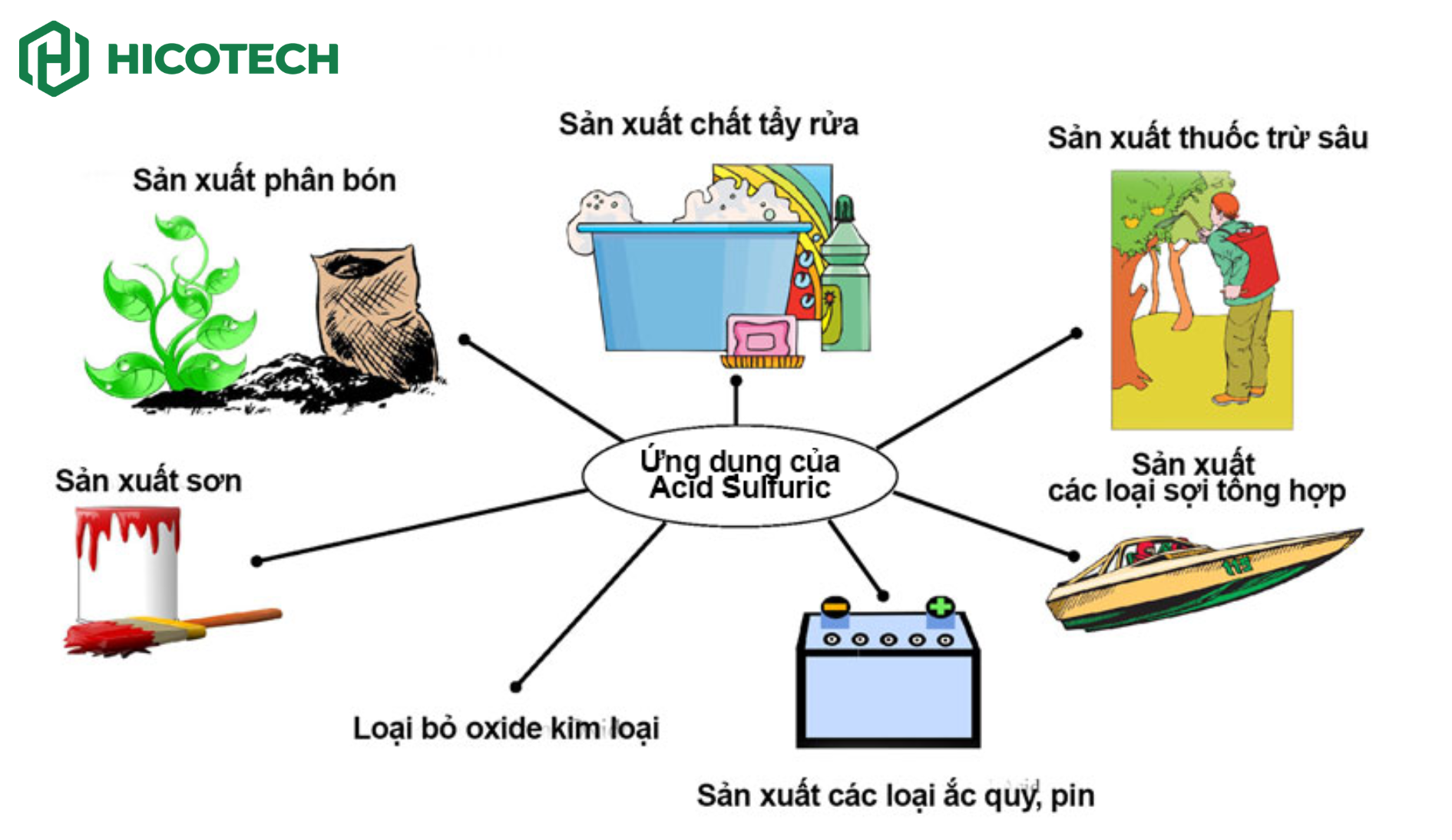
Axit sulfuric (H₂SO₄) là thành phần quan trọng trong chất điện phân, được dùng để sản xuất pin xe hơi.
Axit cacboxylic có thể phản ứng với rượu để tạo ra este, một hợp chất có hương thơm và được ứng dụng rộng rãi trong ngành công nghiệp mỹ phẩm và thực phẩm.
Những axit mạnh như H₂SO₄, HCl, HNO₃ có vai trò quan trọng trong công nghiệp hóa chất và chế biến khoáng sản.
Axit clohydric (HCl) được sử dụng trong ngành khai thác dầu mỏ, giúp hỗ trợ khoan giếng dầu, nâng cao hiệu suất khai thác.
Trong ngành chế tác kim hoàn, hỗn hợp HCl và HNO₃ đậm đặc (theo tỷ lệ 3:1) được gọi là nước cường toan, có khả năng hòa tan vàng và bạch kim, hỗ trợ quá trình tinh luyện kim loại quý.
Ứng dụng trong thực phẩm
Axit đóng vai trò là chất phụ gia trong ngành chế biến và bảo quản thực phẩm, đặc biệt trong các loại đồ uống có ga và thực phẩm đóng hộp nhằm kiểm soát độ pH và kéo dài thời gian sử dụng.
Ứng dụng trong nông nghiệp
Axit cũng được sử dụng trong sản xuất phân bón, điển hình như amoni nitrat (NH₄NO₃), được tạo ra từ phản ứng giữa amoniac (NH₃) và axit nitric (HNO₃).
Ứng dụng trong y học
Axit acetylsalicylic (hay còn gọi là aspirin) được sử dụng như một loại thuốc giảm đau, hạ sốt và chống viêm.
Axit boric có đặc tính khử trùng, giúp điều trị vết thương hở nhỏ, bỏng nhẹ và thậm chí có thể pha loãng để làm dung dịch rửa mắt. Ngoài ra, axit boric còn được sử dụng để điều trị mụn trứng cá, bệnh phồng rộp chân ở vận động viên và bảo quản mẫu nước tiểu trong phòng thí nghiệm.
Ứng dụng trong sinh học
Axit amin là thành phần không thể thiếu trong quá trình tổng hợp protein, hỗ trợ sự sửa chữa mô và phát triển cơ thể ở sinh vật.
Axit nucleic (ADN và ARN) đóng vai trò quan trọng trong lưu trữ và truyền đạt thông tin di truyền, đảm bảo sự di truyền của các đặc tính từ thế hệ này sang thế hệ khác.
Axit cacbonic (H₂CO₃) giúp duy trì sự cân bằng pH trong cơ thể, đảm bảo hoạt động ổn định của hệ thống sinh hóa bên trong.








Có 0 bình luận, đánh giá về Axit là gì? Tính chất hóa lý, ứng dụng trong đời sống
TVQuản trị viênQuản trị viên
Xin chào quý khách. Quý khách hãy để lại bình luận, chúng tôi sẽ phản hồi sớm